蒲尚昆,王 磊,谭安江,魏国清,*
(1.安徽农业大学生命科学学院,合肥 230036;2.江苏科技大学生物技术学院,江苏镇江 212100;3.中国农业科学院蚕业研究所,江苏镇江 212100)
Paired-box (PAX)家族蛋白是在20世纪80年代末发现的一类包含“配对(paired)”DNA结合域的转录因子,被称为“主要调控因子”,广泛存在于脊椎动物到和无脊椎动物中(Thompsonetal.,2021)。该家族所有成员都包含了1个保守的配对结构域(paired domain,PD),有的成员还选择性地包含其他2个结构域:八肽域(octapeptide,OP)和同源结构域 (homeodomain,HD) (李莉等,2012)。在哺乳动物中发现了9个pax基因:pax1-pax9,其中pax3同时含有3个结构域,在黑腹果蝇Drosophilamenalogaster基因组中paired(prd)和gooseberry(gsb)这两个基因都与pax3同源(Liu and Xue,2012)。在哺乳动物中,pax3的功能缺失会影响中枢神经系统、神经嵴细胞的正常发育和肌肉生成(Chappelletal.,2009),从而导致神经管和肢体肌肉缺损(Bhagavatietal.,2007);
在果蝇中,prd在奇数体节的不同区域激活了下游体节极性基因engrailed(en),wingless(wg)和gsb的表达。这些基因的相继表达对维持果蝇胚胎发育过程中前后轴的位置是必需的(Belletal.,2020)。prd和gsb的突变体都会造成表皮条纹的缺失(Liu and Xue,2012)、体节发育的异常(Grahametal.,2019)及胚胎致死等表型,正是因为prd和gsb两个基因属于上下游基因,所以分别敲除之后会产生相似的表型。除此之外,gsb在中枢神经系统发育过程中也发挥着重要的调控作用。gsb功能的缺失除了会造成表皮异常外,也会造成中枢神经系统的发育缺陷(Marieetal.,2010)。prd的杂合突变体果蝇无法发育到成虫阶段,在幼虫期全部致死(Small and Levine,1991)。此外,prd与成虫雄蝇的生育力也有很大的关系,有研究表明prd-gsb或prd-pax3虽然可以缓解prd突变对幼虫的影响,使其能发育到达成虫期,但是所有的雄蝇的都丧失了生育能力(Baumgartner and Noll,1990)。
pax3的功能虽在哺乳动物及果蝇中已有了较为充分研究,但在果蝇以外的昆虫中研究还非常薄弱,本研究以鳞翅目模式昆虫家蚕Bombyxmori为对象,利用CRISPR/Cas9转基因定点敲除技术,对Bmpax3展开功能研究。其结果将有助于阐明pax3在鳞翅目昆虫生长发育中的作用,以期为后续深入研究Bmpax3在家蚕生长发育中的功能和调控机制提供基础。
1.1 家蚕的饲养
本研究中所用的野生型家蚕是由江苏科技大学生物技术学院家蚕分子遗传改良实验室提供的非滞育的Nistari品系。家蚕幼虫在温度25~28℃、相对湿度60%~75%条件下使用新鲜桑叶饲养。
1.2 家蚕pax3序列的验证
通过NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)下载Bmpax3基因序列,并且标记其外显子和内含子,利用在线网站(www.crispr.dbcls.jp)预测其sgRNA候选位点,选用2个序列特异性较高的靶向位点,以靶点所在外显子处设计引物Bmpax3-1F/R和Bmpax3-2F/R (表1)进行PCR扩增及测序确认pax3序列。PCR反应体系(50 μL):10×Buffer 5 μL,MgSO43 μL,dNTP Mixture (2 mmol/L) 5 μL,上下游引物(10 μmol/μL)各1 μL,提取家蚕DNA作为模板(200 ng),KOD酶0.5 μL,双蒸馏水补足到50 μL。扩增程序:98℃ 10 s;98℃ 10 s,55℃ 30 s,68℃ 30 s,38个循环;68℃延伸10 min。4℃存放备用。
1.3 Bmpax3的表达模式的qRT-PCR检测
为了明确Bmpax3的表达模式,对家蚕5龄第3天幼虫头、表皮、脂肪体、中肠、马氏管、前部丝腺、中部丝腺、后部丝腺和生殖腺(包括精巢和卵巢)进行解剖取样,提取总RNA,使用TaKaRa公司的PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒,按照使用说明合成cDNA,使用TOYOBO公司的SYBR Green Real-time PCR Master Mix进行qRT-PCR,使用Life Technologies公司的StepOnePlus qRT-PCR仪进行荧光数据的收集,使用家蚕核糖体蛋白基因Rp49作为内参基因,使用Oligo 7软件设计引物(表1)。每个样品自3头家蚕幼虫混合取样,点样时进行3个技术重复。qRT-PCR反应体系:SYBR Green Real-time PCR Master Mix 10 μL,上下游引物(10 μmol/μL)各1 μL,cDNA模板1 μL,无酶水补足到20 μL。反应程序:95℃ 30 s;95℃ 5 s,60℃ 15 s,40个循环;
72℃ 10 s。用2-ΔΔCt法进行基因相对表达量的计算。
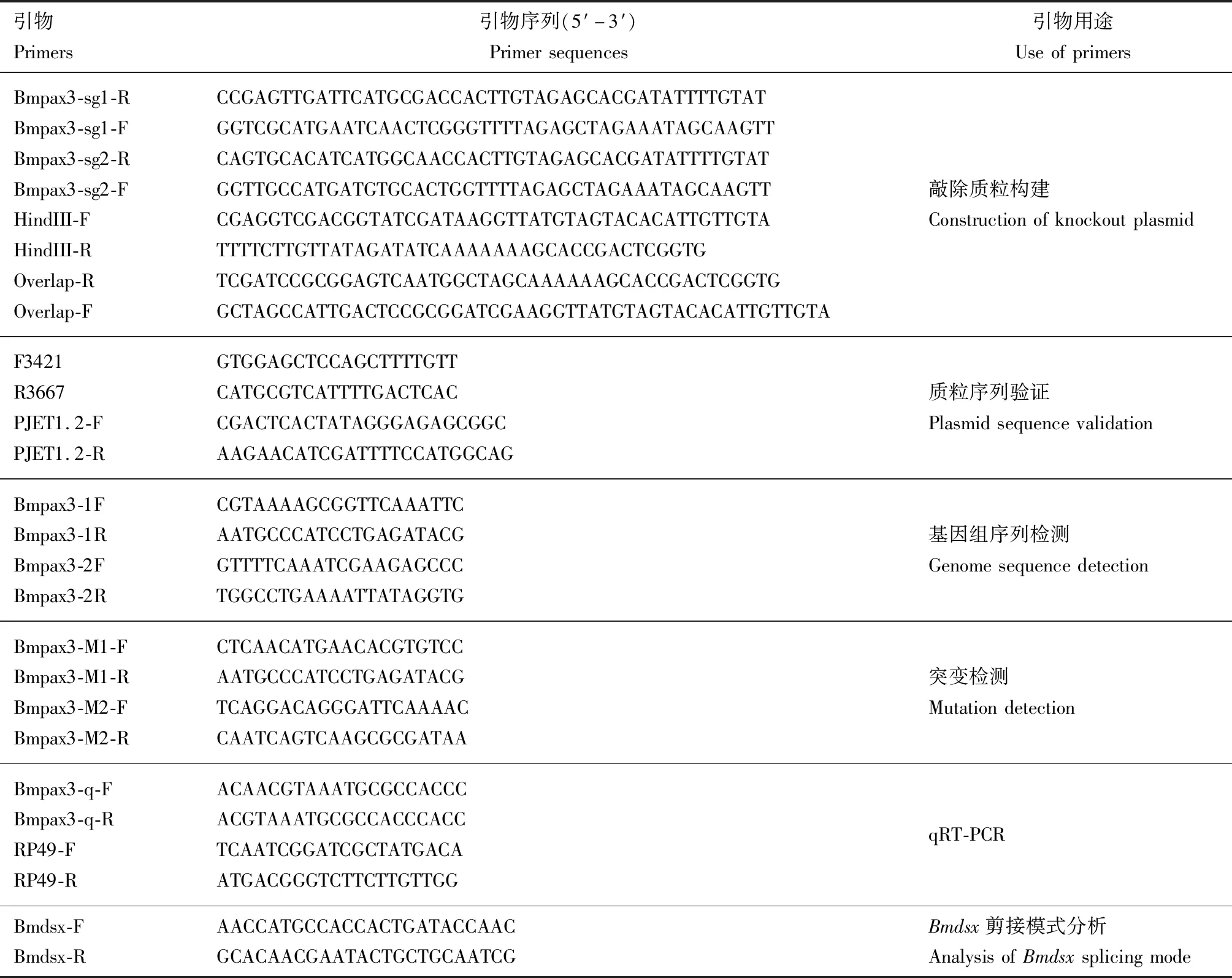
表1 引物信息Table 1 Primer information
1.4 Bmpax3突变体的构建
利用引物HindⅢ-F和Bmpax3-sg1-R从pBac[IE1-DsRed2]原始质粒中用KOD-Plus酶扩增出U6启动子,退火温度为55℃,延伸时间为30 s,扩增得到约500 bp的产物;
同样用Bmpax3-sg1-F和Overlap-R扩增出Overlap部分产物进行跑胶,得到123 bp DNA产物,再用回收的产物与引物HindⅢ-F和Overlap-R进行搭桥扩增出第1个sgRNA,以此便将sgRNA1靶点成功地插入到U6启动子中。同理,按照上述方法扩增出第2个sgRNA。最后用KOD-Plus酶通过桥连PCR分别对应的两个U6和sgRNA组装成U6-sgRNAs单元,并利用Vazyme公司的多片段同源重组试剂盒ClonExpress®MultiS One Step Cloning Kit将它们和用限制性内切酶HindⅢ进行的单酶切原始载体进行同源重组。成功构建sgRNA表达载体pBac[IE1-DsRed2-U6-sgRNAs](图1:A),转化后进行大量提取质粒。将家蚕产下8 h以内的蚕卵用清水缓缓冲洗2 min,洗掉表面的鳞毛,整齐摆放在用75%酒精浸泡后的玻璃片上,用胶水将卵固定在玻璃片上,随后便可将构建的转基因载体(终浓度为400 ng/μL)、helper质粒(终浓度为400 ng/μL)以及编码PiggyBac转座酶的mRNA(终浓度为200 ng/μL)混合通过显微注射导入到产下后蚕卵中,共注射了480粒蚕卵,注射完后用少量胶水封口。将注射后的蚕卵放在密闭的盒子里,加湿后放入25℃的培养箱中催青,在第5天后每天将蚕卵放于灯光下通风30 min。11 d后,收集G0代蚁蚕进行饲养,至成虫期后与正常个体家蚕进行交配并收集蚕卵。待蚁蚕孵化后使用荧光显微镜筛选带有红色荧光的个体即可得到G1代阳性个体。当G1代个体发育到成虫时,将其与实验室已有的nos驱动Cas9表达pBac[IE1-EGFP-nos-Cas9]转基因家蚕品系的成虫进行杂交(Tanetal.,2013),交配6 h之后,将雌雄个体拆对,留下雌蛾产卵。产下的蚕卵在恒温箱里放置10 d,当幼虫孵化之后挑选带有红光及绿光的家蚕进行饲养,得到F1代突变体(图1:B),使用引物F3421/R3667和PJET1.2-F/R(表1)进行质粒序列验证。

图1 Cas9表达载体的构建(A)和Bmpax3位点突变示意图(B)Fig.1 Construction of Cas9 expression vectors (A) and schematic diagram of mutation sites of Bmpax3 (B)A:nos启动子驱动Cas9蛋白的表达。IE1启动子驱动的DsRed2和EGFP分别作为两个载体的筛选标记;两个U6启动子分别驱动两个sgRNA的表达Schematic diagram of expression of Cas9 protein driven by nos promoter.DsRed2 and EGFP driven by IE1 promoter were served as the selection markers of two vectors,respectively.The expression of two sgRNAs is driven by two U6 promoters.NLS为核定位序列。NLS stands for nuclear localization sequence.B:突变体(M1和M2)与野生型之间进行序列比对。白色方框分别表示 Bmpax3的 6个外显子。红色箭头指sgRNA 靶点1 (TS1)和 sgRNA 靶点2 (TS2)均位于2号和5号外显子正义链上。第一条序列为野生型序列。黑色碱基表示靶点序列,红色碱基为PAM序列。虚线表示被删除掉的碱基,序列后面的数字代表删掉的碱基数目。Sequence alignment was perfomed between the mutants M1 and M2 and the wild-type (WT).The white boxes indicate the six exons of Bmpax3.The sgRNA targeting sites TS1 and TS2,indicated by red arrow,are both located in the sense strand of the exon-2 and exon-5.The target site is denoted in black,and the PAM sequence is marked in red.The dashed lines indicate the deleted residues,and the deletion sizes are shown to the right of each sequence.
1.5 Bmpax3突变检测
获得F1代之后选择双阳的个体进行突变检测:在家蚕基因组中距离靶点位置300~400 bp的位置设计引物Bmpax3-M1-F/R和Bmpax3-M2-F/R(表1),以突变体的基因组为模板,使用KOD-Plus酶进行PCR扩增反应。之后将PCR产物进行电泳,切胶后使用Omega公司的Gel Extraction Kit回收DNA片段。将回收得到的产物连接到pJET-1.2载体上,进行转化涂板并37℃培养箱培养12 h后,在超净工作台上用无菌牙签挑单克隆接种到96孔摇菌板上,每个孔加300 μL含有100 μg/mL氨苄青霉素的LB液体培养基,置于37℃摇床上培养3~4 h,用Taq酶进行进行菌落PCR,选择与目的条带相等或者小的单克隆菌落进行菌液测序,将测序结果与正常个体的相应基因的DNA序列进行比对,确认是否发生突变及突变发生的位点
1.6 Bmpax3基因突变体分析
每代杂交至少获得3个蛾圈,杂交3代,每一代将每个蛾圈的双阳性个体(约100头)和只带有单色荧光的个体(200头)筛选之后单独饲养,同时与正常家蚕个体在相同条件下进行培养,观察1龄幼虫的生长情况,并对幼虫的死亡率及发育情况进行统计,同一代3个蛾圈得到的数据取平均值。当存活的个体发育到蛹期时,将突变体的雌雄分开,对雌雄成虫的数目进行统计并记录。统计雌雄成虫末端体节异常的个体数目,同时对异常体节进行拍照。
1.7 性别特异性分析
由于突变发生在末端体节并且对生殖器官存在一定的影响,为了确认Bmpax3是否参与了性别决定的调控通路,本研究对家蚕性别调控双性基因Bmdsx的特异剪接体进行分析,已知Bmdsx在家蚕体内会存在两种剪接形式,一种以长片段的分子在雌性家蚕体内存在,另一种以相对短片段在雄性体内存在。很多基因对性别的调控都是通过影响Bmdsx的剪接,进而调控性别分化。提取Bmpax3突变体和野生型蛹期第4天雌雄个体的脂肪RNA并反转录合成cDNA,以其为模板用Bmdsx特异性引物Bmdsx-F/R(表1)在KOD-Plus酶的作用下进行RT-PCR反应,检测Bmdsx雌雄特异性转录本,转使用TaKaRa公司的PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒按照使用说明合成cDNA,体系为Anchored Oligo(dT)18 Primer 1 μL,随机引物1 μL,2×TS Reaction Mix 10 μL,TransScriptR RT/R1 Enzyme Mix 1 μL,gDNA Remover 1 μL,无酶水补足到 20 μL。反应程序:42℃ 15 min,85℃ 5 s,4℃保存。后续PCR过程参照方法1.2节。收集野生型家蚕5龄第3天幼虫雌性和雄性个体的头、表皮、脂肪体、中肠、马氏管、前部丝腺、中部丝腺、后部丝腺和生殖腺(包括精巢和卵巢)进行解剖取样,提取总RNA,使用TaKaRa公司的PrimeScriptTMRT Reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒,按照使用说明合成cDNA,并以其为模板用特异性引物Bmpax3-q-F/R(表1)和SYBR Green Real-time PCR Master Mix 进行qRT-PCR反应(实验设计同1.3节),检测分析雌雄个体间Bmpax3表达量差异。
1.8 数据分析
将得到的数据使用Graphpad Prism 8软件进行数据分析以及绘图。差异显著性是通过双尾t检验并进行分析。
2.1 Bmpax3的表达模式
结果表明,Bmpax3在家蚕5龄第3天幼虫的不同组织中表达存在一定的差异(图2)。Bmpax3在前部丝腺中表达量最高,在中部丝腺、头和中肠中表达量较高,在后部丝腺、精巢及卵巢中有少量的表达,而在表皮、脂肪体和马氏管中几乎没有检测到表达,可以看出其表达不具有组织特异性。

图2 家蚕5龄第3天幼虫不同组织中Bmpax3的表达模式Fig.2 Expression pattern of Bmpax3 in different tissues of the day-3 5th instar larvae of Bombyx moriHead:头Head;Cu:表皮Cuticle;FB:脂肪体Fat body;MG:中肠Midgut;MT:马氏管Malpighian tubules;ASG:前部丝腺Anterior silk gland;MSG:中部丝腺Middle silk gland;PSG:后部丝腺Posterior silk gland;Gonad:生殖腺(包括精巢和卵巢)Gonads including testis and ovary.图5同。The same for Fig.5.
2.2 Bmpax3突变对幼虫生存的影响
Bmpax3突变体的蚕卵孵化率能达到90%(n=90)左右,与对照组正常个体的蚕卵孵化率相比并无显著差异(P>0.05)。但是收蚁之后,约有80%(n=80)突变体蚁蚕拒绝进食,即使有部分个体最初能进食,当进食1~2 d之后,也会停止食桑,最后只剩下约15%(n=15)的幼虫入眠、蜕皮,继续发育到达2龄,但是部分个体生长发育受到了严重影响,其中少部分幼虫生长几乎停滞在3龄,明显表现为龄期延长,期间能少量进食,但不能跨越4龄,即不能进入眠期,更不能进行蜕皮,导致最终死亡;
最后仅有大概10%(n=10)的突变个体能顺利发育到成虫阶段,存活个体数与野生型对照组相比各生长阶段没有显著差异(P>0.05)(图3:A),且成功化蛹后雌雄成虫数量存在显著差异(P<0.05)(图3:B),雌成虫数量少甚至没有,雄成虫数量接近存活总数的70%(n=7),表明当Bmpax3发生突变时对家蚕雌性幼虫生存能力的影响更大。

图3 家蚕Bmpax3突变体存活个体数(A)和成虫数量(B)Fig.3 Number of survial individuals (A) and number of adults (B) of Bmpax3 mutants of Bombyx moriWT:野生型Wild-type;△Bmpax3:突变体Mutant;L1-L5:分别为1-5龄幼虫1st-5th instar larvae,respectively;P:蛹Pupa;Ad:成虫Adult.下图同The same for the following figures.图中数据为平均值±标准误;
采用双尾t检验检测两组数据的差异显著性(**P<0.01;***P<0.001)。图5同。Data in the figure are the mean±SE.Two-tailed t-test was used to detect the difference between the two groups (**P<0.01;***P<0.001).The same for Fig.5.
2.3 Bmpax3突变体成虫腹部末端体节缺陷
Bmpax3突变体在1龄幼虫时期大部分死亡,部分存活个体的个体末端体节发育也发生了异常,造成蛹期时部分突变体尾部出现体表条纹混乱,这使雄性个体表现出介于雌性和雄性之间的表型,而雌性突变体则表现出不规则的分节(图4:A)。随着蛹的发育,突变体发育到成虫阶段时,其末端体节存在发育缺陷,并且可以更加准确地分辨性别,尽管在蛹期雄性突变体的体节会出现与雌性相似的条纹,但是其成虫依然保持其雄性特征,并未出现雌性化。通过显微观察可以清楚看到不论是雌性突变体还是雄性突变体,它们的腹节腹板都有部分缺失,并且末端体节发育不良,分节混乱,导致腹面或者是背面只有少量鳞毛甚至没有鳞毛所覆盖。生殖器官及其周围的其他辅助器官出现不同程度的损伤(图4:B)。
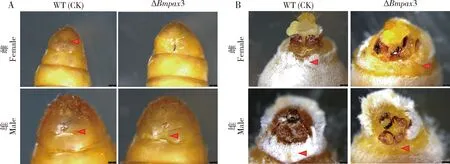
图4 家蚕Bmpax3突变体蛹(A)和成虫(B)末端体节的异常形态Fig.4 Abnormal morphology of the terminal segments in pupae (A) and adults (B) of Bmpax3 mutants of Bombyx mori红色三角形指示突变发生处。The red triangles indicate the occurring sites of mutation.
2.4 Bmdsx性别特异性剪接及Bmpax3表达的性别差异
RT-PCR检测结果表明(图5:A),Bmpax3的突变并未影响突变体Bmdsx的雌雄特异性剪接,证明Bmpax3可能并没有参与性别调控,突变体所表现的末端体节的异常并没有对性别的分化产生影响。将双阳性的雌雄突变体分别与正常家蚕个体进行交配,发现无表型缺陷的双阳突变体能够正常交配,产生的后代也能够正常孵化;
相反地,存在表型缺陷的突变体,不论雌性个体还是雄性个体,即使能表现出正常的求偶行为,最终都不能完成交配。同时个体的死亡主要发生在幼虫期,为了检测该基因在野生型家蚕雌雄体内的表达差异,对5龄第3天幼虫正常个体各组织基因表达量进行qRT-PCR检测,分析其在雌雄个体间的表达差异,结果显示在5龄第3天幼虫期时,雌雄个体的头(P<0.001)、中部丝腺(P<0.001)、后部丝腺(P<0.01)及生殖腺(精巢和卵巢) (P<0.001)中的Bmpax3表达量存在显著差异(图5:B),由此推测家蚕雌雄突变体所表现出的存活率差异可能主要由Bmpax3在雌雄个体间的表达量差异所导致。总之,Bmpax3的功能与幼虫的存活及成虫的末端体节正常发育密不可分。

图5 通过Bmpax3剪接体表达量分析家蚕Bmpax3突变体性别二态性(A)和野生型5龄第3 天雌雄幼虫不同组织中Bmpax3的表达量 (B)Fig.5 Sexual dimorphism of Bmpax3 mutants through the analysis of the expression level of Bmpax3 splicesome (A) and the expression levels of Bmpax3 in different tissues of the day-3 5th instar female and male larvae of the wild-type Bombyx moriBmdsxF:雌性特异剪接体Female-specific isoform;BmdsxM:雄性特异剪接体Male-specific splicing isoform.
pax3在模式生物黑腹果蝇及哺乳动物中的研究已相当成熟(Relaixetal.,2005),但在鳞翅目及其他昆虫中的具体功能尚不清楚。根据已有的研究表明,Bmpax3在进化上十分保守,并且它的同源基因在果蝇体内发生突变时都会表现出明显的表型缺陷。在本实验中我们运用双元基因CRISPR/Cas9系统实现对Bmpax3的小片段缺失,在获得的嵌合突变体中,出现了较为严重的表型缺陷。
已知果蝇的gsb基因及其同亚家族基因是prd,其在一定层度上可以调节gsb的表达,有研究表明prd和gsb突变所导致的表型缺陷是相近的(He and Noll,2013),它们都属于pax3的同源基因;
而在家蚕中,目前只有Bmpax3属于pax3同源基因。研究表明,果蝇gsb在神经细胞及表皮细胞中高度表达;
而本研究检测到Bmpax3在家蚕5龄第3天幼虫头、中肠、前部丝腺、中部丝腺中都能检测到表达(图2),在前部丝腺中所检测到的表达量最高,在表皮、脂肪体、马氏管、后部丝腺及生殖腺中表达量极低。进一步研究发现在头、中部丝腺、后部丝腺及生殖腺中,表达量存在显著的性别差异(图5:B),结果显示在正常的雌性家蚕个体中,Bmpax3的表达量明显比雄性高,与Bmpax3发生突变时雌性存活率更低可能存在一定联系。果蝇gsb基因主要对幼虫角质层和中枢神经系统的发育、成虫期的存活和雄性生殖等过程都是必需的(Ouelletteetal.,1992),有研究表明当其发生突变时会造成表皮条纹的缺失、体节发育的异常及胚胎致死等表型。这一表型与本研究在家蚕中得到的结果相似,Bmpax3突变导致幼虫大部分死亡,并且主要发生在1龄幼虫早期,推测可能在其胚胎时期已存在缺陷,导致突变体即使能成功孵化,也会在孵化后陆续死亡;
也可能是Bmpax3的突变影响了与幼虫取食相关的器官或基因,导致幼虫不能进食而导致死亡。根据已有的研究表明前者的可能性更大。同时,果蝇prd基因与雄蝇的生育力也有很大的关系(Underhilletal.,2012)。同时prd也与甲虫的体节分化有关(Davisetal.,2001)。而本研究结果中,有极少部分突变体能发育到成虫阶段(图3),其中部分个体腹部末端体节分节异常,生殖器官附近的其他保护器官缺损,表皮条纹紊乱等现象,同时产生表型突变的个体不育(图4)。以上结果说明家蚕中Bmpax3可能既参与了胚胎发育的调控,对1龄幼虫的存活起到关键作用,同时也在体节分化过程起到了重要的调控作用,间接导致了突变体的不育。由于Bmpax3突变所引起的表型非常复杂,涉及的表型众多且具有致死性,突变体存活个体少等原因,造成对其在家蚕体内的具体调控途径的探索具有一定难度。根据Bmpax3在家蚕体内功能的初步探索,推测在其他昆虫特别是鳞翅目昆虫体内也发挥着至关重要的作用,为该基因功能的进一步研究及其调控家蚕生长发育的机制奠定了基础。