顾欣然,代敏丽,王遐坤,仲思银,李 兵,卫 静,2*
(1. 苏州大学 基础医学与生物科学学院,江苏 苏州 215123;
2. 福建农林大学 植物保护学院,福建 福州 350002)
双翅目寄蝇(Tachinidae)作为自然界中仅次于膜翅目寄生蜂的第二大类群寄生性昆虫,在害虫种群控制和维持生态平衡方面具有重要的作用,目前全世界已记载的寄蝇有1477属8592种[1,2]。寄蝇是农林牧业害虫生物防治的重要天敌资源,被广泛应用于害虫如松毛虫、粘虫等的生物防治[3,4]。同时,部分寄蝇也是危害经济昆虫家蚕(Bombyx mori)和柞蚕(Antheraea pernyi)的主要害虫[5,6]。
家蚕是重要的经济昆虫,也是国际无脊椎动物协会确定的鳞翅目模式昆虫[7]。生产上对家蚕和柞蚕危害最大的是追寄蝇(寄蝇科、追寄蝇属)和饰腹寄蝇(寄蝇科、饰腹寄蝇属)[8]。它们属于完全变态昆虫,幼虫期包括3个龄期,雌蝇将尚未完成胚胎发育的卵产于寄主体表或食料植物上,幼虫在寄主体表或消化道内孵化后钻入寄主体腔内,3 龄幼虫末期钻出寄主化蛹[9]。目前蚕业生产上防治寄蝇主要利用“灭蚕蝇”对家蚕进行添食或体外喷施,而寄蝇已对该药物产生了抗性,防治效果逐渐下降,有研究表明在长期广泛使用“灭蚕蝇”的地区的蝇蛆抗药性可达极少使用该药地区的3.32 倍[10]。目前关于追寄蝇的了解多在其生物生态学特性与寄生规律上[5,11,12],研究多集中在生物防治方面,而对追寄蝇寄生后家蚕的生长发育和二者互作的分子机制研究较少,这大大制约了蚕业生产中追寄蝇防控技术和药物的开发。
已有研究表明,家蚕追寄蝇偏向于寄生末龄家蚕幼虫,寄生率达48%,因而其对大蚕期(末龄期家蚕)危害较大[13]。寄生不仅可激活家蚕的免疫反应[14~16],也会导致家蚕出现早熟现象,使家蚕茧质变劣且死亡率较高[17],而家蚕追寄蝇寄生的引起家蚕早熟的机制尚不清楚。我们前期研究发现一种非专化性双翅目寄蝇—日本追寄蝇(Exorista japonica)的寄生可引起家蚕上蔟提前,但出现化蛹障碍,这一现象产生的原因主要是寄生导致寄主激素和糖代谢异常所致[18]。家蚕的变态发育主要受由蜕皮激素20-羟基蜕皮酮(20-hydroxyecdysone,20E)启动[19]。20E 及其前体蜕皮酮(ecdysone)主要是以食物中的胆固醇或植物固醇类物质为原料在昆虫前胸腺及外周组织合成,经由“Halloween”基因(Sro、Spo、Phm、Dib、Sad、Shade)编码的蛋白酶的催化。20E 通过与其受体EcR/USP 形成复合体,启动下游转录因子如E75、Hr3和Ftz-f1等的表达。其中Ftzf1的精准表达时间是保证昆虫正常蜕皮和变态所必须的。20E 对Ftz-f1 存在负调控作用,Ftz-f1 是在20E消失后进行表达[20]。本试验统计了追寄蝇寄生家蚕的龄期经过,并初步探索了寄生对家蚕20E 合成和信号通路调控机制,通过本研究可以更好地了解追寄蝇对寄主生长发育的调控,为后续深入研究其调控机制提供基础。
1.1 供试家蚕和追寄蝇品种
供试家蚕品种为“菁松×皓月”,由东台市天润蚕种有限公司提供,饲养温度25 ℃±1 ℃、相对湿度75%±5%,12 h 黑暗12 h 光照交替。供试追寄蝇品种为家蚕追寄蝇,由江苏如皋市蚕桑技术指导站提供,置于养虫笼(45 cm×30 cm×30 cm)中饲养,饲养温度25 ℃±1 ℃、相对湿度85%。
1.2 试验方法
1.2.1 实验材料收集
取5龄1 d的家蚕置于饲有羽化3 d的追寄蝇培养箱中,供追寄蝇产卵,家蚕与追寄蝇的数量比为1∶30。3 h 后取出,在放大镜下观察家蚕体壁,选取出体表仅有1粒卵的家蚕继续饲养。同时取未被追寄蝇寄生的家蚕作为对照组。对照组和寄生组均设置3组重复,每次重复各20头蚕。记录家蚕从5龄起蚕(day 1 of 5th instar,L5D1)发育至预蛹期第2 d(day 2 of prepupa stage,PP2)的时间。同时解剖并收集寄生后1 d~6 d(家蚕处于5 龄3 d-吐丝期第1 d)(L5D3-day 1 of spinning stage,L5D3-SP1)及对照组家蚕的血清、脂肪体和前胸腺,每个时间点取3个组织样品重复,每个组织样品来源于5 头家蚕组织的混合。
1.2.2 RNA提取及cDNA的合成
采用液氮研磨家蚕前胸腺和脂肪体,利用TRIzol(Takara)法提取RNA,加入DNase去除基因组DNA 的污染。利用超微量分光光度计NanoDrop 2000 检测RNA 的浓度和纯度。取1 μg 的总RNA,采用M-MLV RTase试剂盒反转录合成cDNA的第1条链(Takara)。
1.2.3 目的基因的转录水平检测
以cDNA 为模板,Rp49 为内参基因测定20E 合成 基 因(BmSro,BmSpo,BmPhm,BmDib,BmSad,BmShd)和下游基因(BmUSP,BmEcRA,BmE75,BmBrc,BmHr3,BmE93)mRNA 的表达。采用SYBR Premix Ex Taq™(Takara)试剂盒在ABI Viia 7 Realtime PCR仪上进行。反应体系为20 μL:cDNA模板1 μL,2×SYBR Premix Ex Taq 10 μL,50×ROX Ref⁃erence Dye 0.4 μL,10 mM 上下游引物各0.5 μL,ddH2O 7.8 μL。反应条件为:95 ℃变性1 min;
95 ℃5 s,55 ℃10 s,72 ℃10 s,共45 个循环;
72 ℃终延伸10 min。采用2−ΔCT的方法分析基因的转录水平。每个基因的转录水平为3 个生物学重复的平均值。引物序列见表1。

表1 qPCR引物序列Table 1 qPCR Primer Sequence
1.2.4 20E 滴度的检测
根据20E 酶联免疫检测试剂盒(三价公司)说明,利用试剂盒提供的标准品制作标准曲线,取10 μL血清溶解于试剂盒中的ELISA buffer,样品最终稀释度为5 倍。将样品加于酶标板底部并混匀,37 ℃反应30 min,洗板后加入酶标试剂,37 ℃反应30 min,洗板后加入显色液显色10 min,加入终止液,15 min内读取OD值并根据标准曲线计算20E滴度。
1.3 统计分析
利用K-S 检验分析实验数据分布的一致性,利用T检验对两组数据进行显著性分析。实验数据用平均数±标准差(Mean±SD)表示,其中*P<0.05,**P<0.01,***P<0.001。利用SPSS 19.0(SPSS,Chicago,IL,USA)对实验数据进行分析。利用GraphPad Prism 7绘图软件对实验数据进行绘图。
2.1 家蚕追寄蝇寄生对5龄家蚕龄期的影响
追寄蝇在家蚕体表产卵的2.5 d~3 d后,卵下方或者周边出现寄生黑点,表明孵化的幼虫成功侵入家蚕体内(图1A)。幼虫在蚕体内发育至3龄,成熟的3龄幼虫在家蚕预蛹后期钻出。未寄生的对照组家蚕从5 龄起蚕(L5D1)发育至预蛹期第2 d(PP1)历经10.8 d,寄生组为10.1 d(图1B)。

图1 追寄蝇寄生家蚕的龄期统计Fig. 1 The Effect of E. sorbillans Parasitization on the Development of the Host B. mori.
2.2 家蚕追寄蝇寄生对5龄家蚕血清中20E滴度的影响
利用酶联免疫分析检测追寄蝇寄生后1 d、3 d和5 d 的家蚕和未寄生的对照家蚕血清中的20E 滴度。结果显示:在对照组和寄生组家蚕血清中,20E的滴度均随着家蚕龄期的增长而增加。在寄生后第1 d,对照组和寄生组家蚕体内20E滴度无显著差异。在寄生后第3 d 和第5 d,寄生组家蚕体内的20E 滴度均显著高于对照组,分别是对照组的1.23和1.50倍(图2)。
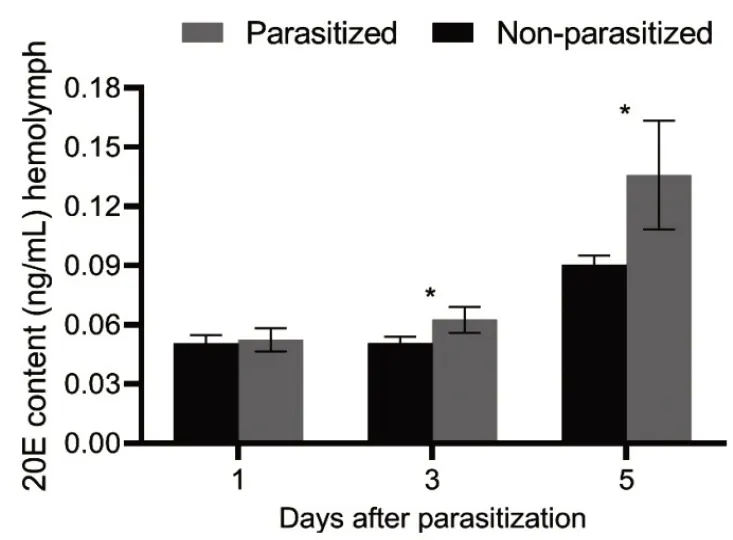
图2 追寄蝇寄生家蚕体内20E滴度的检测Fig. 2 Detection of 20E Titers in B. mori Parasitized by E. sorbillans
2.3 追寄蝇寄生对5龄家蚕前胸腺中20E合成酶基因转录水平的影响
利用实时荧光定量PCR检测追寄蝇寄生家蚕的前胸腺中20E 合成酶基因(BmSro,BmSpo,BmPhm,BmDib,BmSad,BmShd)的表达变化。结果如图3 所示,在寄生1 d时,寄生组家蚕BmSro,BmSpo,BmPhm,BmDib和BmSad的转录水平显著低于对照组,而BmShd的相对表达量显著高于对照组(图3A)。家蚕BmSro,BmPhm,BmSad和BmShd的转录水平在寄生后第3 d 显著高于对照组,分别是对照组的1.41,1.23,2.91 和1.24 倍,而BmSpo和BmDib的转录与对照组相比无显著变化(图3B)。在追寄蝇寄生后的第5 d,BmSro,BmSpo,BmPhm和BmSad的转录水平显著高于对照组,BmDib和BmShd的转录无显著变化(图3C)。因此,追寄蝇可调控家蚕前胸腺20E合成酶基因的表达,进而调控家蚕体内20E的合成。

图3 追寄蝇寄生对家蚕20E合成酶基因转录调控的分析Fig. 3 Analysis of the Transcriptional Regulation of 20E Biosynthetic Genes in B. mori Parasitized by E.sorbillans.
2.4 追寄蝇寄生对5龄家蚕脂肪体中20E下游基因转录的影响
接下来,我们利用实时荧光定量PCR 检测追寄蝇寄生对家蚕20E 信号通路上的重要响应基因(BmUSP,BmEcR- A,BmFtz- f1,BmE75,BmBrC,BmHr3,BmE93)表达水平的影响。结果如图4所示,在寄生1 d 和3 d,BmE75,BmHr3,BmBrC,BmE93和BmFtz-f1持续上调表达,是对照组的1.38~9.36 倍(图4 A,B)。在寄生后第5 d,BmEcR-A和BmE93的转录水平显著高于对照组;
而BmHr3,BmBrC和BmFtz-f1的表达受到抑制,转录水平分别是对照组的0.08,0.10 和0.24 倍(图4C)。这些结果表明,追寄蝇寄生调控寄主家蚕20E下游应答基因的转录。

图4 追寄蝇寄生对家蚕20E信号通路基因转录调控的分析Fig. 4 Analysis of the Transcriptional Regulation of 20E Signaling Pathway Genes in B. mori by the Parasitism of E. sorbillans.
近年来,国内外对追寄蝇的寄生行为、寄生规律和危害状况调查有一定成果,但对其具体寄生机制的深入研究尚且缺乏。已有研究报道,追寄蝇寄生3龄~5 龄初期家蚕造成的寄主死亡率接近100%[13],但追寄蝇对家蚕影响的调查尚不全面。本研究中,5龄1 d的家蚕被追寄蝇寄生后,出现提前进入预蛹期的现象,同时,成熟的追寄蝇3龄幼虫均在家蚕预蛹期钻出化蛹。已有研究发现多种寄生蜂和寄蝇调控寄主发育的方式主要有两种,一种为加快寄主发育,导致寄主早熟,另一种则导致寄主发育受阻,使寄主滞留在特定时期[18,21,22],表明寄生性昆虫通过调节寄主发育创造更适合其自身的寄主环境的现象具有普遍性。
完全变态昆虫的发育主要由蜕皮激素20E和保幼激素(juvenile hormone,JH)相互拮抗、协调控制,其滴度的改变能够诱导昆虫进入特定的发育阶段,如蜕皮和化蛹[19,23]。前期研究发现,日本追寄蝇可通过诱导家蚕体内20E 滴度的上升和JH 滴度的下降进而加快寄主发育[18],而本试验同样发现家蚕追寄蝇寄生可以通过诱导家蚕体内20E合成以及影响20E 信号传导调控家蚕的龄期经过,推测家蚕追寄蝇可能也通过调控寄主激素代谢进而加快其发育。家蚕体内20E滴度在5龄末期之前极低,在5龄末期即徘徊期开始急剧上升,在预蛹期达到峰值,而在预蛹后期迅速下降,形成20E脉冲,同时家蚕完成预蛹-蛹的转变[24]。而这一过程的成功完成也需要JH滴度变化来共同调控,家蚕在5龄初期时处于JH 滴度高峰,而在5 龄期末期JH 滴度则快速下降,在5龄末到蛹期的阶段,JH 滴度急剧下降到几乎为0,从而使20E 不受到拮抗而诱导蛹化变态[24]。因此,家蚕追寄蝇的寄生可能不仅调控20E 的合成与信号通路,还对JH 的合成和信号传导有调控作用,进而加快寄主幼虫发育。
此外,在昆虫中,Hr3 可直接上调Ftz-f1 的表达,而E75 可直接结合Hr3 抑制Ftz-f1 表达,因此Hr3 可通过正负反馈调控Ftz-f1 表达控制昆虫的发育变态[25]。本研究中发现,追寄蝇寄生后第5 d,20E 滴度持续上升,导致Hr3 和Ftz-f1 的转录均被下调。20E 的过量合成可加快寄主的发育,但同时会导致下游信号转导异常,使家蚕无法完成正常的发育。
猜你喜欢家蚕滴度龄期家蚕原原种“871”“872”种性变化分析四川蚕业(2022年2期)2022-11-19塑钢纤维混凝土早龄期力学性能研究湖南城市学院学报(自然科学版)(2022年6期)2022-11-14不同富集培养方法对噬菌体PEf771的滴度影响昆明医科大学学报(2022年2期)2022-03-29重组腺相关病毒基因药物三种滴度的比较与分析华侨大学学报(自然科学版)(2021年4期)2021-07-30多龄期锈蚀钢结构框架柱力学性能研究中国测试(2021年6期)2021-07-18自身免疫性肝病诊断中抗核抗体与自身免疫性肝病相关抗体检测的应用价值中国保健营养(2021年16期)2021-04-03抗BmNPV家蚕新品种“川抗1号”的育成四川蚕业(2021年2期)2021-03-09家蚕猝倒病的发生与防治四川蚕业(2021年1期)2021-02-12浙江省1973年引进家蚕品种名蚕桑通报(2015年1期)2015-12-23不同冲击条件下早龄期混凝土的力学特性中国有色金属学报(2015年6期)2015-03-18