钟 丽,陶小平,张志斌
(广州工商学院,广东 广州 510800)
骨质疏松症(Osteoporosis,OP)是一种以机体骨量减少、骨小梁数量减少、变细、断裂,同时骨皮质变薄、孔数增多为主要特征的衰老表现,与骨脆性增加、骨折风险增高密切相关,是临床中骨科的多发病之一[1-2]。我国60岁以上人群中OP发病率可达50%以上,50岁以上的女性中,约25%患有OP,同时由OP而引起髋关节骨折的男性约为40%[3]。骨主要承担支撑身体、保护内脏器官的作用,同时参与Ca代谢。在机体的全生命周期中,骨组织受内环境及遗传、运动、生活方式等外界因素的影响,呈动态变化[4]。一方面,破骨细胞持续吸收骨,同时成骨细胞持续生成骨,维持动态平衡。人体的骨量在生长期时逐渐增加,在25岁成熟期时达到峰值,此后随年龄的增加而逐渐降低。研究表明,运动产生的力学刺激可以有效调节骨发育,对骨生长和骨形状、强度等解剖学结构产生影响,进而预防的OP发生[5]。
目前研究已知,Wnt通路、Notch通路、MAPK通路及Hedgehog通路是调节骨代谢的主要通路[6-7],其中Wnt通路起主导作用,可通过减少细胞凋亡、促进骨细胞生成进而促进骨结构恢复,增加骨量。而研究证实,短链脂肪酸(Short Chain Fat Acid,SCFA)对OP可起到较好的防止作用,且运动可影响SCFA的表达,此外SCFA的表达与Wnt通路的激活有关。基于此背景,本研究通过给予OP大鼠运动干预,探究运动对SCFA及Wnt通路的影响。
1.1 实验动物与主要仪器、试剂
1)实验动物:选取SPF级雌性SD大鼠共45只,体重200±20g,购于中国科学院上海实验动物中心,许可证号SCXK(沪)2008-0016。
每笼5只,常规喂养。
室温(20±1)℃,遵循12h/12h昼夜交替,室内保持通风良好,自由进食进水。
2)主要实验仪器:双能X线骨密度仪器 (GE Lunar Prodigy,美国);
全自动组织脱水机(樱花公司,日本);
组织包埋机(美康EC-350,德国);
电子万能试验机(INSTRON,美国);
荧光摄像系统(Leica,德国);
冷冻离心机(Eppendorf,德国);
3)主要试剂:3%戊巴比妥钠;
定量试剂盒 (大连TAKARA,中国);
PCR引物(上海生工,中国);
反转录试剂盒(大连TAKARA,中国)。
1.2 动物分组与造模
将45只雌性SD大鼠按照随机数字表法,随机分为对照组、假手术组与实验组,每组各15只。对照组与实验组采用去卵巢法建立骨质疏松模型。将大鼠依照35mg/kg剂量注射戊巴比妥麻醉后,从腹正中线暴露腹腔,结扎双侧卵巢后依次缝合肌肉和皮肤。假手术组在打开腹腔后,仅切术卵巢周围部分脂肪组织,随后缝合皮肤。各组大鼠在造模后,于臀肌处注射庆大霉素(0.01ml/kg),连续注射3天。
1.3 干预方法
对照组大鼠与假手术组大鼠仅进行常规喂养,无运动干预。
实验组大鼠进行跑台运动干预:跑台设定速度为0.8km/h,坡度为0°,每次训练30min,每周训练5天,共进行12周训练。
1.4 实验指标
1.4.1 大鼠一般情况比较
造模后1d,观察记录各组大鼠的精神状态、活动状态、毛发光泽度、饮水、睡眠、排便排尿情况。
1.4.2 骨密度测定
参考文献的方法以L2作为骨密度和骨组织形态学的研究对象。
将大鼠麻醉后(7%水合氯醛,腹腔注射0.5ml/100g),断头处死。取出大鼠L2椎体和右侧股骨,将软组织清理干净后,采用骨密度测量仪测定其骨密度。
1.4.3 骨组织形态学观察
取大鼠L2椎体,软组织清除干净后,选用4%多聚甲醛液固定48h,随后用14%EDTA液脱钙处理2周,并进行脱水、透明、包埋、切片,制成3~4μm石蜡切面,HE染色处理后于镜下观察骨组织形态学变化。
1.4.4 骨生物力学测定
L2椎体骨密度测定完毕后,将棘突、横图、软骨终板、椎板等修剪后,放置于试验机上进行椎体压缩实验,压缩速率为6mm/min,记录各组大鼠的弹性模量和最大载荷。
1.4.5 相关mRNA水平
将大鼠左侧股骨软组织清楚后,使用DEPC浸泡的锡箔纸包裹,放入液氮中冻存。检测时,将样本从液氮中取出并制成粉末,向样本中加入TRIzol300μl混匀,静置5min。随后加入氯仿0.2ml,混匀后静置3min。选用高速离心机将样本以4℃、5 000r/min离心20min,将上层水液取至另一离心管内,加入0.5ml异丙醇后混匀静置10min,随后以4℃、5 000r/min离心10min,弃掉上层清液,向样本内加入75%乙醇1ml,洗涤后以4℃、5 000r/min离心5min,弃去上层清液,室温下干燥约10min后加入DEPC水20μl溶解。将99μlDEPC加入至1μl样品中,测定总RNA样品的浓度和纯度。
依照试剂盒说明书,进行逆转录:加入2μl第一链反应缓冲液、0.5μl逆转录酶、总RNA 2μl、Oligo dT引物0.5μl,随后加入DEPC水补齐至10μl,混匀后静置20min。随后85℃加热15s,与冰水中静置备用。参考试剂盒操作说明 (大连TAKARA)开始PCR反应:按照94℃5min—94℃15s—60℃50s次序,循环扩增共40次。将β-actin作为内参,对目的基因进行定量。在60℃条件下检测荧光值进而得出CT值,并计算相对定量。引物基因序列详见表1。

表1 引物基因序列
1.4.6 SCFA含量测定
收集各组大鼠干预前后的粪便备用。取0.2g样品置于离心管内,加入0.5ml纯水溶解后,旋涡1min后以10 000r/min离心5min,过滤后移入2ml离心管内备用。向离心管内加入50μl 50%的H2SO4溶液,再加入750μl内标溶液,旋涡1min后以10 000r/min离心5min,置于4℃冰箱内冷却30min,随后选用气相色谱分析法样品中乙酸、丙酸、丁酸含量。选用16S rDNA法对SCFA含量进行测序分析。
1.5 统计学方法
选用SPSS 22.0对数据进行统计分析,计量资料选用均数±标准差表示,组间比较选用单因素方差分析,两两组间比较采用LSD-t检验。以p<0.05表示差异具有统计学意义。
2.1 各组大鼠一般情况比较
各组大鼠在造模后均无死亡。对照组大鼠出现进食减少、活动减少、毛色失去光泽等表现。假手术组大鼠进食、活动及皮毛光泽无异常表现。实验组大鼠的进食、活动较对照组有所改善,毛发光泽有所恢复。
2.2 各组大鼠骨密度比较
结果表明,与假手术组大鼠相比,对照组大鼠的L2椎体和股骨的骨密度明显降低,同时实验组大鼠的L2椎体密度和股骨的骨密度较对照组大鼠明显提高,差异均具有统计学意义(p<0.05)。
详见表2。
表2 各组大鼠骨密度比较(g/cm2,)

表2 各组大鼠骨密度比较(g/cm2,)
注:与假手术组相比,*p<0.05;
与对照组相比,#p<0.05;
下表同
组别 n假手术组150.165±0.014股骨骨密度 L2椎体0.178±对照组实验组15 15 0.126±0.009*0.142±0.010#骨密度0.019 0.145±0.016*0.160±0.017#
2.3 各组大鼠骨组织形态学比较
结果表明,对照组小鼠可见骨小梁数目下降,同时骨小梁变薄变细且排列紊乱欠规则,同时骨髓腔扩大伴有微骨折等。假手术组大鼠骨小梁排列整齐规则,无间隙增大的情况。实验组大鼠的骨小梁排列尚为规则整齐,骨小梁有所变细,且部分区域的骨小梁间隙稍微大。
2.4 各组大鼠骨生物力学比较
结果表明,与假手术组大鼠相比,对照组大鼠的L2椎体弹性模量及最大载荷明显降低,同时与对照组大鼠相比,实验组大鼠的L2椎体弹性模量及最大载荷明显提高,差异均具有统计学意义(p<0.05)。
详见表3。
表3 各组大鼠生物力学指标比较()

表3 各组大鼠生物力学指标比较()
组别 n假手术组对照组实验组15 15 15 802.52±209.20 593.13±136.03*750.41±170.31#弹性模量(GPa) 最大载荷(N)192.12±57.05 132.81±41.02*179.18±51.60#
2.5 各组大鼠mRNA表达比较
结果表明,与假手术组相比,对照组大鼠股骨的βcatenin、Lrp-5、Osx、Runx2 mRNA的表达明显下降, 而与对照组相比,实验组大鼠的 β-catenin、Lrp-5、Osx、Runx2 mRNA的表达明显升高,差异均具有统计学意义(p<0.05)。详见表4。
表4 各组大鼠mRNA表达比较()

表4 各组大鼠mRNA表达比较()
组别 n假手术组对照组实验组15 15 15 1.20±0.18 0.87±0.16 1.22±0.21 β-catenin Lrp-5 2.17±0.40 1.80±0.33 2.12±0.37 Osx 1.15±0.17 0.93±0.09*1.13±0.16#Runx2 1.41±0.15 0.98±0.07*1.36±0.09#
2.6 各组大鼠治疗前后SCFA含量比较
干预前,与假手术组相比,对照组、实验组大鼠的乙酸、丙酸、丁酸含量均下降,干预后,实验组大鼠的SCFA含量均较干预前升高,明显高于对照组,差异均具有统计学意义 (p<0.05)。
详见表5。
表5 各组大鼠干预前后SCFA含量比较(mmol/l,)
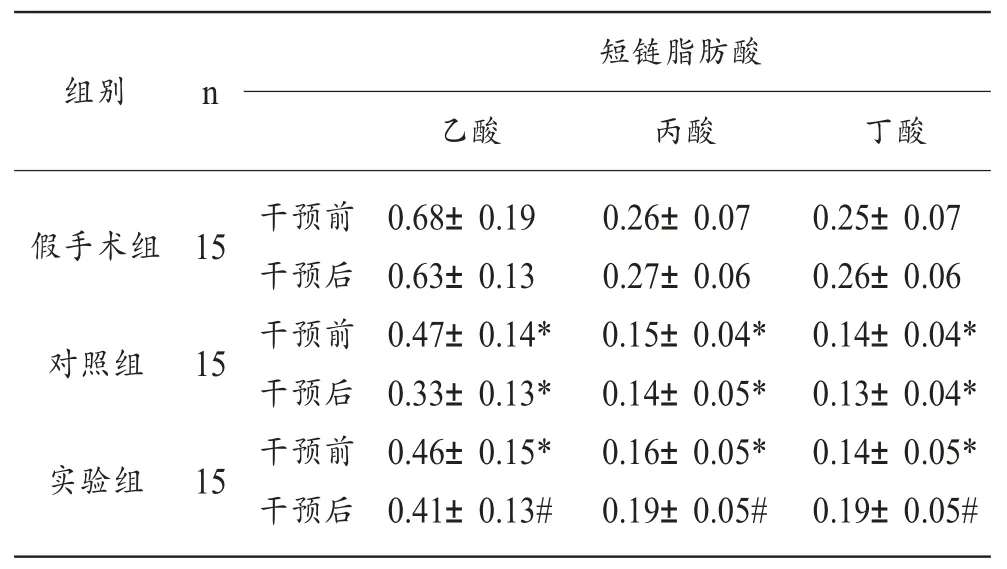
表5 各组大鼠干预前后SCFA含量比较(mmol/l,)
短链脂肪酸组别 n乙酸 丙酸 丁酸假手术组15对照组15实验组15干预前干预后干预前干预后干预前干预后0.68±0.19 0.63±0.13 0.47±0.14*0.33±0.13*0.46±0.15*0.41±0.13#0.26±0.07 0.27±0.06 0.15±0.04*0.14±0.05*0.16±0.05*0.19±0.05#0.25±0.07 0.26±0.06 0.14±0.04*0.13±0.04*0.14±0.05*0.19±0.05#
OP是临床中常见的骨科疾病,以机体的骨结构退化伴有单位体积内骨量下降及骨脆性增加为主要特征,易引起肌力下降、疼痛以及骨折等并发症[8]。本研究中,对照组大鼠出现明显的饮食不加、毛发光泽下降等改变,而实验组大鼠上述症状较轻,提示运动可改善OP导致的饮食减退、活动减少等并发症的发生风险。考虑这可能与运动改善了大鼠骨质疏松病情进而提高肌力和缓解疼痛有关。早期OP起病较为隐匿,随着病情进展可出现压缩骨折、脊柱变形等形态改变,严重影响患者的日常生活[9]。OP的发生与机体的遗传因素、内分泌水平、营养水平、免疫因素及生活方式等密切相关。机体的破骨-成骨是一动态平衡过程,针对这一过程,临床中常采用加强抗骨吸收、促进骨形成等药物治疗,前者包括降钙素、雌激素替代疗法、选择性雌激素受体拮抗剂等,后者常选用甲状旁腺素、胰岛素样生长因子及氟化物等[10]。绝经后OP是原发性OP的一种证型。雌激素在调控骨骼系统中发挥重要作用,当女性绝经后,卵巢功能逐渐衰退,进而导致骨代谢改变[11]。本研究中,选用模拟绝经后的OP模型开展研究。HE染色结果示造模后大鼠出现明显的OP病理改变,提示造模成功。
同时本研究中HE染色结果显示,对照组大鼠出现骨小梁排列紊乱、数目下降、骨小梁变薄及骨髓腔增大伴少量微骨折等OP病理性表现,实验组大鼠上述病理改变有所减轻,骨小梁排列尚整齐规则,间隙略有增加,提示运动能有效的减缓OP进程,改善骨组织形态。骨密度是OP的诊断标准之一,能够有效的预测骨折风险,也是评价治疗效果的参考[12]。双能X线骨密度测定是一种广泛认可的定量分析方法。结果表明,实验组大鼠的骨密度明显高于对照组,提示运动能有效的改善OP大鼠的骨质疏松状态,延缓OP大鼠的骨密度下降。OP患者的骨折发生风险较普通人高,骨强度的下降与脆性骨折的发生关系密切,骨强度可有效反馈机体抗骨折的能力[13-14]。本研究中选用生物力学测试比较各组大鼠的骨强度,结果表明,实验组大鼠的弹性模量与最大载荷均明显高于对照组,提示运动能有效改善OP大鼠的骨强度,改善其骨生物力学参数,提高抗骨折能力。
Wnt/β-catenin通路是调控骨代谢的重要通路,在调节骨发育、形成、吸收重建中发挥重要作用[15]。β-catenin是Wnt通路的关键分子,在成骨细胞分化以及功能形成中发挥重要作用。Lrp-5是Wnt蛋白辅助受体之一,在骨量积累过程中发挥重要作用。Runx2是成骨细胞转录中的关键转录因子,通过上调软骨细胞和成骨细胞中相关矿化蛋白基因的转录进而促进新骨形成[16]。Osx是成骨细胞分化的特异性转录因子之一,在骨形成和成骨细胞分化中发挥重要作用,是经典Wnt/βcatenin通路的下游基因[17]。当Wnt识别到辅助受体脂蛋白受体相关蛋白 (Lipoprotein Receptor Related Protein5/6,LRP5/6)后,促进β-catenin向核内迁移并与转录因子复合物结合,随后激活Runx2并促进下游基因表达[18]。本研究结果表明,与假手术组相比,对照组大鼠股骨的 β-catenin、Lrp-5、Osx、Runx2 mRNA的表达明显下降,而与对照组相比,实验组大鼠的βcatenin、Lrp-5、Osx、Runx2 mRNA的表达明显升高, 提示运动可能通过激活Wnt/β-catenin通路进而发挥缓解OP相关症状、改善OP表现的作用。
SCFA是由肠道有益菌产生的代谢物,既往研究表明,SCFA对OP有较好的防治作用,可以通过抑制破骨细胞分化、促进成骨等途径进而改善OP相关症状。Xie等[19]研究结果显示,SCFA的表达可靶向调控Wnt/β-catenin的表达。Tindaro[20]等最新一项研究证实,运动可通过调控SCFA的表达进而运动员免疫力和能量代谢过程。本研究结果表明,干预前,与假手术组相比,对照组、实验组大鼠的乙酸、丙酸、丁酸含量均下降,干预后,实验组大鼠的乙酸、丙酸、丁酸含量均较干预前升高,明显高于对照组,提示运动能够有效提高OP大鼠的SCFA含量,进而发挥改善OP的作用。而运动干预后SCFA含量的增加与Wnt通路的签在关联机制仍需进一步研究。
综上,运动可能通过上调SCFA含量、激活Wnt/β-catenin通路改善大鼠的骨密度度、骨生物力学参数和骨组织形态,继而改善OP相关症状。
猜你喜欢骨密度椎体通路预防骨质疏松,运动提高骨密度中老年保健(2022年3期)2022-08-24经皮椎体成形术中快速取出残留骨水泥柱2例报道中华骨与关节外科杂志(2021年12期)2021-08-31天天喝牛奶,为什么骨密度还偏低保健医苑(2021年7期)2021-08-13不要轻易给儿童做骨密度检查中国生殖健康(2019年2期)2019-08-23老年骨质疏松性椎体压缩骨折CT引导下椎体成形术骨水泥渗漏的控制策略探讨中华骨与关节外科杂志(2016年3期)2016-05-17超声检查胎儿半椎体1例淮海医药(2015年1期)2016-01-12椎体内裂隙样变对椎体成形术治疗椎体压缩骨折疗效的影响中国继续医学教育(2015年6期)2016-01-07OSTEOSPACE型超声骨密度仪故障案例解析中国医学装备(2015年10期)2015-12-29Kisspeptin/GPR54信号通路促使性早熟形成的作用观察中国病理生理杂志(2015年8期)2015-12-21proBDNF-p75NTR通路抑制C6细胞增殖医学研究杂志(2015年3期)2015-06-10