郑会珍,普 浩,缪荣浩,甘 露,葛晓敏,巴音查汗,李永畅,郭庆勇
(**农业大学动物医学学院,乌鲁木齐 830052)
牛环形泰勒虫病是一种蜱传性血液原虫病,由寄生于牛的巨噬细胞、淋巴细胞和红细胞内环形泰勒虫(T.annulata)引起,急性感染时可致宿主高热、贫血、黄疸及体表淋巴结肿大等症状[1-2]。小亚璃眼蜱与亚洲璃眼蜱作为媒介蜱导致其发病具有明显的季节性和地域性[3]。牛环形泰勒虫病高发病率和高死亡率导致牛产奶量及产肉量降低,给养牛业带来了严重的经济损失,严重阻碍了畜牧业的健康发展[4]。近年来,由于耐药性寄生虫的进化和传播及疫苗的缺乏为寄生虫病的控制和消除带来极大挑战,早发现、早治疗是目前解决该病的方法。
烯醇化酶(2-phospho-D-glyceratehydrolyase,enolase)在糖酵解中通过催化2-磷酸甘油酸形成磷酸烯醇式丙酮酸为宿主提供能量。enolase在多种生物体内高度保守[5],有多种生物学功能,enolase可与纤溶酶原(plasminogen,Plg)、纤维连接蛋白(fibronectin,Fn)结合,从而对宿主产生影响[6]。研究发现,不同位置的enolase可对疟原虫产生不同影响,在表面可能参与红细胞入侵;
囊泡内可能参与食物泡形成,而细胞核内的enolase可能在转录中发挥作用[7]。enolase可位于卵细胞表面,但配子细胞、配子和受精卵表面不存在。疟原虫入侵时,动合子表面的enolase不仅结合蚊子中肠上皮受体来入侵其中肠,且赖氨酸肽段(DKSLVK)可结合动合子表面的纤溶酶原激活寄主纤溶系统来侵染宿主[8]。Sato等[9]发现,enolase也可用于疟疾免疫诊断。由于enolase的保护性抗原特性[10-12],对其深入研究可使人们更清楚其在寄生虫入侵宿主、供能中的相关作用,也为潜在的疫苗候选抗原、诊断治疗方法和药物筛选研究奠定基础。
本试验克隆了牛环形泰勒虫**株enolase基因并分析其编码蛋白质的遗传进化关系,预测enolase的理化性质、二级结构特点、三级结构模型、亚细胞定位、构建蛋白互作网络并通过抗原性分析对其理论抗原位点进行标记,以期为后续为牛环形泰勒虫enolase基因特性、候选疫苗、药物靶点的相关研究提供思路和数据支持。
1.1 材料
pGEX-4T-1(+)表达载体及牛环形泰勒虫标准阳性、阴性血清均由**农业大学动医学学院寄生虫实验室保存;
限制性内切酶BamHⅠ和XhoⅠ、T4 DNA连接酶均购自TaKaRa公司;
2×TaqMasterMix、大肠杆菌DH5α感受态细胞、pMD19-T载体、琼脂糖凝胶回收试剂盒均购自TIGEN公司;
质粒小剂量提取试剂盒购自Omega公司;
大肠杆菌BL21(DE3)感受态细胞和蛋白质分子质量标准均购自宝信生物科技有限公司;
辣根过氧化物酶(HRP)标记的兔抗牛IgG抗体购自北京博奥森生物技术有限公司。
1.2 目的基因克隆及测序
参考GenBank中登录的牛环形泰勒虫enolase基因序列(登录号:HQ_646253)和原核表达载体pGEX-4T-1(+)图谱酶切位点,使用Primer Premier 5.0软件设计引物。引物序列为:pGEX4T-1-enolase-F:5′-CGCGGATCCATGCAA-TTTTTAGATTCCAGAGG-3′(下划线部分为BamHⅠ酶切位点);
pGEX4T-1-enolase-R:5′-CCGCTCGAGCAGCTCTTCTTCGATGC-3′(下划线部分为XhoⅠ酶切位点)。使用DNA提取试剂盒提取牛环形泰勒虫DNA并以其为模板,PCR扩增牛环形泰勒虫**株enolase基因。PCR反应体系13 μL:2×TaqMasterMix 6.5 μL,上、下游引物各0.5 μL,DNA模板 1 μL,ddH2O 4.5 μL。PCR反应条件:95 ℃预变性5 min;
95 ℃变性30 s,50.75 ℃退火30 s,72 ℃延伸1 min,共35个循环;
72 ℃延伸8 min。PCR产物经1.5%琼脂糖凝胶电泳鉴定后使用琼脂糖凝胶回收试剂盒进行切胶回收,目的片段连接至pMD19-T载体(pMD19-T-enolase)后转化大肠杆菌DH5α感受态细胞,于37 ℃、180 r/min摇菌1 h后涂布于Amp+的培养板,于37 ℃培养箱培养过夜,挑取单菌落进行菌液PCR鉴定后送至生工生物工程(上海)股份有限公司测序,测序结果在NCBI-BLAST上比对。
1.3 系统进化树构建
在NCBI中通过BLAST获得不同物种的enolase蛋白氨基酸序列,如小泰勒虫(XP_764336)、东方泰勒虫(XP_009692141)、马泰勒虫(XP_004831211)、牛巴贝斯虫(XP_001611923)、卵形巴贝斯虫(XP_028865010)、双芽巴贝斯虫(XP_012768952)、残留疟原虫(XP_028532717)、冈地弓形虫(AAG60329)。使用Mega 7.0软件的最大似然法,将分析重复数设置为1 000,构建系统进化树。
1.4 enolase重组质粒构建与鉴定
提取pMD19-T-enolase、pGEX-4T-1(+)质粒,用BamHⅠ、XhoⅠ双酶切,使用琼脂糖凝胶回收试剂盒回收后用T4 DNA连接酶16 ℃过夜连接,转化大肠杆菌BL21(DE3)感受态细胞,于37 ℃、180 r/min摇菌1 h后涂布于Amp+的培养板,37 ℃过夜培养,挑取单菌落培养后进行PCR、双酶切鉴定,将阳性菌株(pGEX-4T-1-enolase)送至生工生物工程(上海)股份有限公司测序。
1.5 enolase重组蛋白诱导条件的筛选
将pGEX-4T-1-enolase菌液于37 ℃、180 r/min在10 mL LB液内扩大培养,当菌液D650 nm值达到0.4~0.6时取1 mL菌液作为诱导前对照样品,加入1.0 mmol/L IPTG在0~6 h每小时取样进行诱导时间筛选;
加入不同浓度IPTG(0、0.2、0.4、0.6、0.8、1.0和1.2 mmol/L)进行诱导浓度筛选;
确定最佳诱导时间和诱导浓度后在16、25和37 ℃进行诱导温度筛选。使用SDS-PAGE对筛选的条件进行分析和验证。
1.6 enolase重组蛋白纯化及Western blotting分析
将阳性菌液复苏后在200 mL LB培养基(Amp+)扩大培养,37 ℃、180 r/min培养2.5 h,待菌液D650 nm值达到0.4~0.6时,取1 mL菌液作为诱导前(0 h)对照,加入0.6 mmol/L IPTG在25 ℃诱导5 h,收集菌液沉淀,超声破碎,分别收集上清和沉淀进行蛋白可溶性分析,并进行蛋白纯化。通过SDS-PAGE鉴定后以牛环形泰勒虫阳性血清(1∶100)和兔抗GST标签抗体(1∶2 500)作为一抗、兔抗牛 IgG-HRP(1∶10 000)和羊抗兔IgG-HRP(1∶10 000)作为二抗,经Western blotting鉴定重组蛋白的表达。
1.7 enolase蛋白生物信息学分析
将测序正确的核苷酸序列通过软件翻译为氨基酸序列进行生物学信息分析,软件网站及功能见表1。

表1 生物信息学分析软件网址及其功能Table 1 Website and function of bioinformatics analysis softwares
2.1 牛环形泰勒虫enolase基因扩增
牛环形泰勒虫enolase基因PCR扩增结果见图1。由图1可知,获得大小约为1 248 bp的enolase基因扩增产物,经测序后在NCBI-BLAST比对结果显示,enolase基因与已发表环形泰勒虫(GenBank登录号:HQ_646253)相似性为97.35%。

M,DL2000 DNA Marker;
1、2,牛环形泰勒虫enolase基因;
3,阴性对照 M,DL2000 DNA Marker;1 and 2,enolase gene of T.annulata;3,Negative control图1 牛环形泰勒虫enolase基因PCR扩增结果电泳图Fig.1 Electropherogram of PCR amplification results of enolase gene of T.annulata
2.2 牛环形泰勒虫enolase系统进化树构建
将牛环形泰勒虫enolase与其他物种的氨基酸序列进行相似性比对并构建系统进化树,结果见图2。由图2可知,牛环形泰勒虫enolase与小泰勒虫(XP_764336)亲缘关系较近,与残留疟原虫(XP_028532717)和刚地弓形虫(AAG60329)亲缘关系较远。
2.3 牛环形泰勒虫enolase基因表达载体的构建及验证
使用BamHⅠ、XhoⅠ对pGEX4T-1-enolase重组质粒双酶切,通过1.0%琼脂糖凝胶电泳鉴定,获得大小分别为4 969和1 248 bp的酶切片段(图3),表明原核表达载体pGEX4T-1-enolase构建成功。
2.4 牛环形泰勒虫enolase蛋白诱导条件筛选
使用IPTG诱导pGEX-4T-1-enolase重组质粒,结果显示,在25 ℃、IPTG终浓度为0.2 mmol/L的IPTG诱导3 h时可获得大小约为70 ku的蛋白条带(图4),与预期大小一致。

图2 基于enolase氨基酸序列构建的系统进化树Fig.2 Phylogenetic tree based on enolase amino acid sequences

M1,DL8000 DNA Marker;
1,pGEX-4T-1-enolase重组质粒;
2,pGEX-4T-1-enolase重组质粒双酶切;
M2,DL2000 DNA Marker M1,DL8000 DNA Marker;1,pGEX-4T-1-enolase recombinant plasmid;2,Double enzyme digestion of pGEX-4T-1-enolase recombinant plasmid;M2,DL2000 DNA Marker图3 pEGX-4T-1-enolase重组质粒酶切验证Fig.3 Double restrict digestion of pGEX-4T-1-enolase recombinant plasmid

①A,诱导时间优化;
B,IPTG诱导浓度优化;
C,诱导温度优化。②M,蛋白质分子质量标准;
A1~A7,诱导时间分别为0、1、2、3、4、5和6 h;
B1~B7,IPTG诱导浓度分别为0、0.2、0.4、0.6、0.8、1.0和1.2 mmol/L;
C1,诱导前;
C2~C4,诱导温度分别为16、25和37 ℃ ①A,Optimization of induction time;B,Optimization of induction concentrations of IPTG;C,Optimization of induction temperatures.② M,Protein Marker;A1-A7,The induction time was 0,1,2,3,4,5 and 6 h,respectively;B1-B7,The induced concentrations of IPTG were 0,0.2,0.4,0.6,0.8,1.0 and 1.2 mmol/L,respectively;C1,Before induction;C2-C4,The induction temperatures were 16,25 and 37 ℃,respectively图4 enolase蛋白诱导条件筛选Fig.4 Screening of induction conditions for enolase protein
2.5 牛环形泰勒虫enolase重组蛋白纯化及Western blotting分析
重组蛋白纯化后经SDS-PAGE验证后获得大小为70 ku的单一目的蛋白(图5A),使用超微量分光光度计测定蛋白浓度为0.3 mg/mL。Western blotting结果显示,enolase可与牛环形泰勒虫阳性血清、GST标签发生反应,并在70 ku处出现特异性条带,阴性血清不反应(图5B、5C)。

M,蛋白质分子质量标准;
1,诱导前;
2,诱导后,3,超声后上清;
4,超声后沉淀;
5,纯化后蛋白;
6,抗GST标签抗体7,阴性对照;
8,牛环形泰勒虫阳性血清;
9,阴性对照 M,Protein Marker;1,Before induction;2,After induction;3,Supernatant after ultrasound;4,Precipitation after ultrasound;
5,Purified protein;6,Anti-GST-labeled antibody;7,Negative control;8,Positive serum for Theileria annulata;9,Negative control图5 enolase蛋白纯化(A)及Western blotting(B、C)检测Fig.5 enolase protein purification (A) and detection by Western blotting (B and C)
2.6 enolase蛋白生物信息学分析
2.6.1 理化性质分析 利用ProtParam程序预测牛环形泰勒虫enolase蛋白理化性质,推测该蛋白的分子式为C2003H3212N542O615S17,分子质量为45.27 ku,等电点(pI)为5.91;
带正电氨基酸残基(Arg+Lys)48个,带负电氨基酸残基(Asp+Glu)52个,蛋白亲水性平均系数(GRAVY)为-0.171,不稳定系数为28.53(<40),属于稳定性蛋白。
利用Net-Phos 3.1 Server软件预测发现,enolase有38个磷酸化位点,丝氨酸、苏氨酸和酪氨酸磷酸化位点分别为19、9和10个(图6A)。TMHMM Server v.2.0、Signal 5.0、ProtScale软件预测结果显示,enolase无跨膜区(图6B)、无信号肽(图6C)、亲水性较好(图6D)。

A,磷酸化位点预测;
B,跨膜区预测;
C,信号肽预测;
D,亲疏水性预测 A,Prediction of phosphorylation site;B,Prediction of transmembrane region;C,Prediction of signal peptide;D,Prediction of hydrophilicity and hydrophobicity图6 enolase蛋白生物信息学分析Fig.6 Bioinformatics analysis of enolase protein
2.6.2 蛋白结构预测分析 利用SOPMA软件预测牛环形泰勒虫enolase蛋白的二级结构,其中α-螺旋、无规则卷曲、延伸链和β-转角占比分别为43.03%、33.17%、15.63%和8.17% (图7)。
使用SWISS-MODEL软件预测牛环形泰勒虫enolase蛋白的三级结构(图8),模板号为2akm.1.A,全局模型质量估计(global model quality estimation,GMQE)值为0.86,表明构建的模型合理。
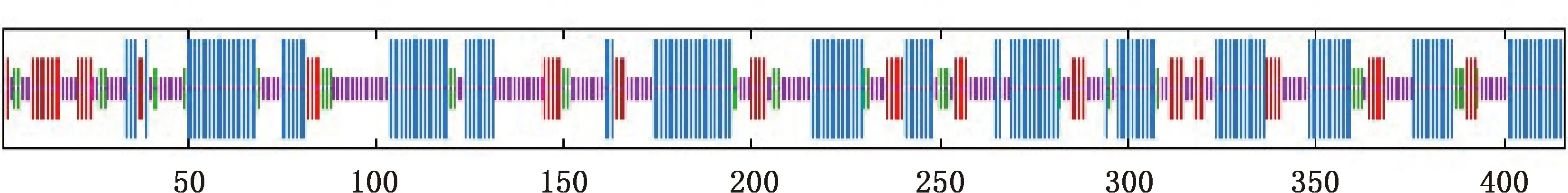
线条由长到短分别代表α-螺旋、无规则卷曲、延伸链、β-转角 The lines represent alpha helix,random coil,extended strand and beta turn from long to short图7 enolase蛋白二级结构预测Fig.7 Prediction of secondary structure of enolase protein
2.6.3 抗原位点预测 用Vaxijen 2.0 在线服务器预测enolase抗原性,默认阈值为0.4时预测结果0.4503,表明 enolase蛋白具有较高的抗原性。由IEDB Analysis Resource预测enolase编码的氨基酸序列有17个抗原表位(表2)。将表中的抗原位点使用EzMol程序进行标记,结果如图9所示。
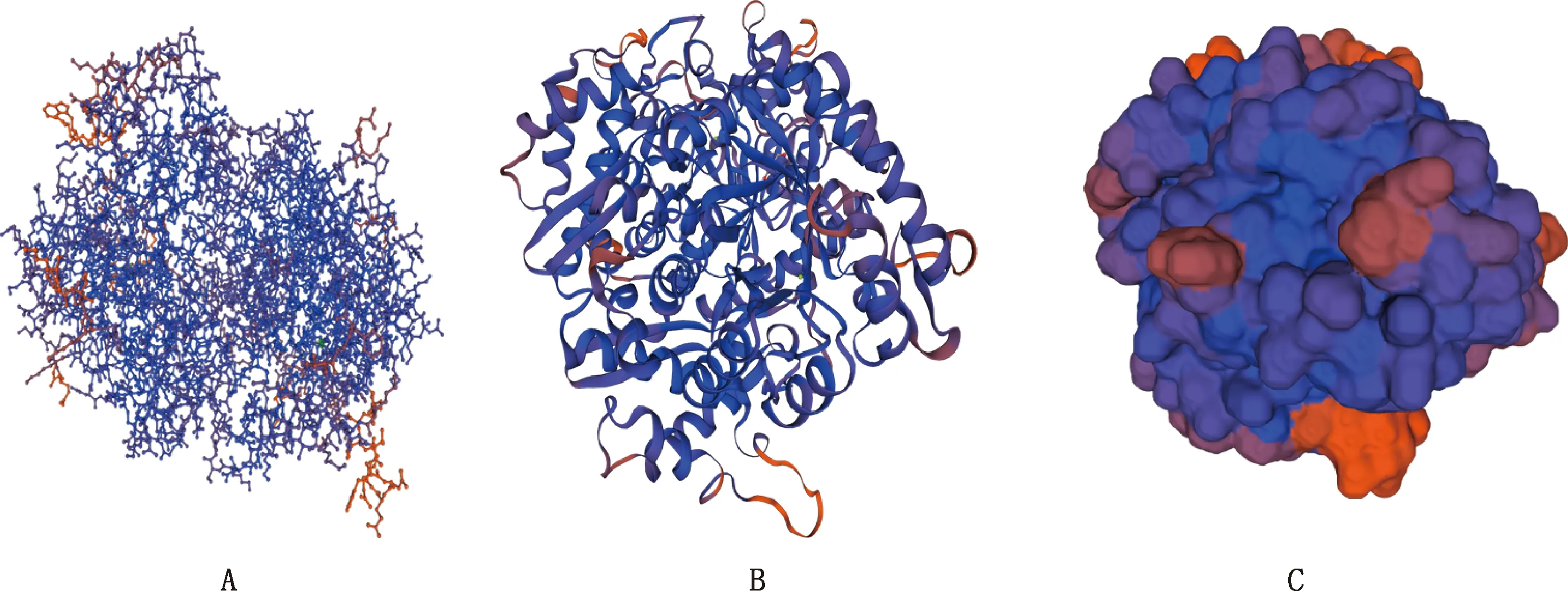
A,骨架式模型;
B,卡通式模型;
C,空间式模型。图9同 A,Skeleton model;B,Cartoon model;C,Spatial model.The same as fig.9图8 enolase蛋白三级结构预测Fig.8 Prediction of tertiary structure of enolase protein

表2 enolase编码氨基酸抗原表位预测Table 2 Prediction of epitopes of amino acids encoded by enolase

图9 enolase基因编码氨基酸抗原位置标记Fig.9 Amino acid antigen location marker encoded by enolase gene
2.6.4 亚细胞定位 通过WoLF PSORT软件亚细胞定位预测发现,enolase蛋白位于细胞各成分的可能性为细胞质22%、核糖体5%、细胞核3%、细胞外1%、溶酶体1%,初步预测了enolase蛋白发挥功能的位置,也与之参与糖酵解的功能相印证。
2.6.5 蛋白互作网络分析 通过STRING在线数据库构建蛋白互作网络,从而预测出与enolase蛋白发生相互作用的蛋白。由图10可知,能与enolase蛋白发生互作的蛋白主要有磷酸甘油酸激酶(PGK)、磷酸甘油酸变位酶(PGAM)、二磷酸核苷激酶(NDK)、热休克蛋白70(HSP70)等。主要参与的生物过程为糖酵解、糖异生、葡萄糖代谢过程、小分子分解代谢、合成等过程,还具有催化活性和结合分子的功能。
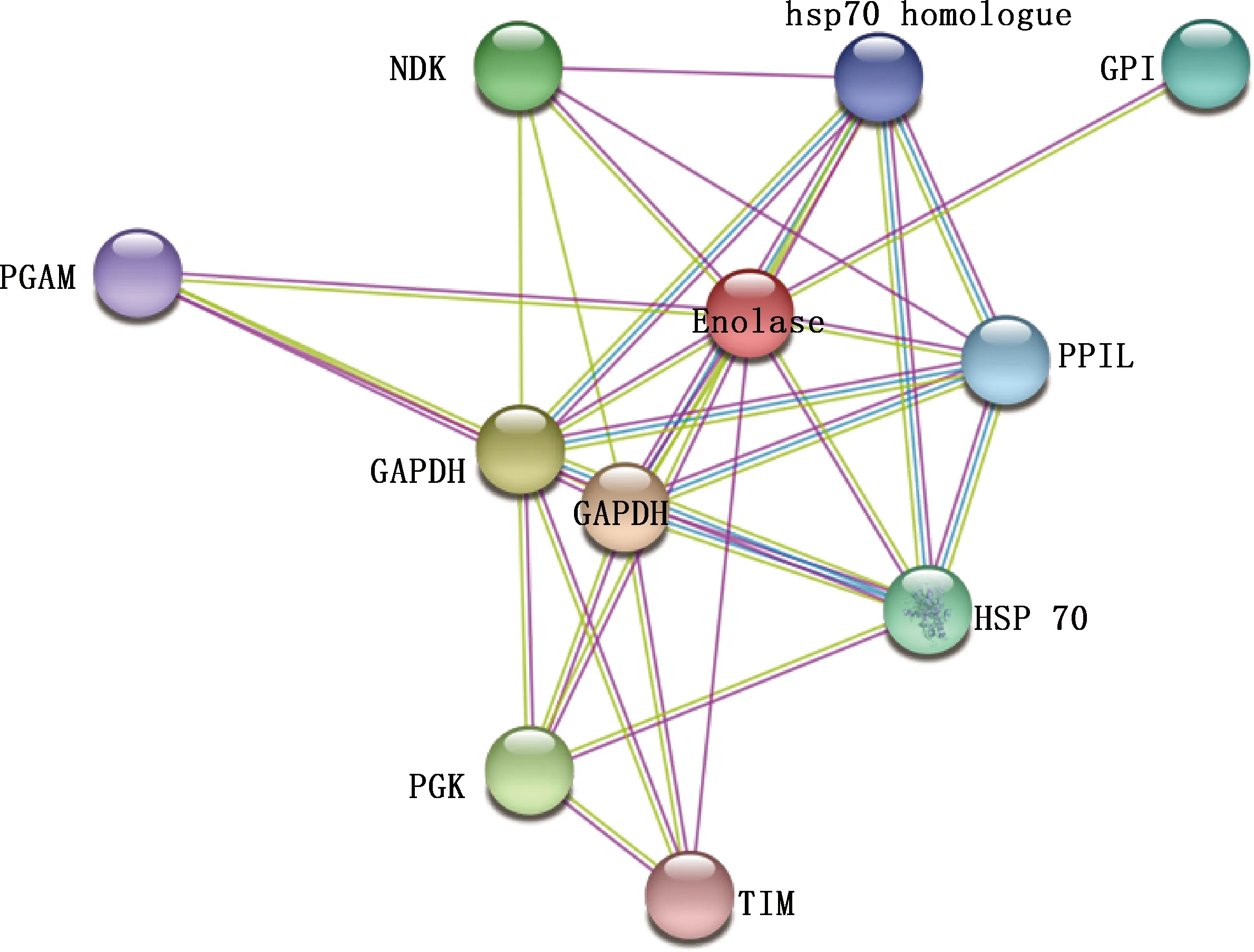
图中两个GAPDH为序列及长度均不相同的旁系同源 The two GAPDH in the figure are paralogs with different sequences and lengths图10 enolase蛋白互作网络图Fig.10 Protein-protein interaction network of enolase protein
据估计,全世界约有2.5亿头牛面临感染蜱传环形泰勒虫的风险[13-14]。然而,目前存在的治疗性化合物布帕伐醌(Buparvaquone,商品名称为Buparvex)暴露于空气中易失效[15],且受限于需早期治疗动物疾病。此外,也有关于环形泰勒虫耐药菌株的报道[16],因此,寻找新方法预防泰勒虫非常重要。
enolase是在原核生物和真核生物[17]中被鉴定为糖酵解过程中产生ATP的关键酶,通过参与细胞的产能过程,从而影响细胞的生命活动。通过基因组测序发现,顶复门寄生虫缺少参与三羧酸循环和β-氧化途径所需酶的基因序列,所以顶复门原虫(Theileriaspp.)主要通过糖酵解生成ATP[18]。本研究通过对enolase基因进行扩增,获得了大小为1 248 bp的扩增产物,其与已发表的环形泰勒虫(GenBank登录号:HQ_646253)相似性为97.35%。成功构建分子质量大小为70 ku的enolase重组蛋白,且以包涵体形式表达。该蛋白与Cayir等[19]构建的环形泰勒虫His-enolase融合重组蛋白可溶性相似,本试验筛选蛋白表达条件发现enolase蛋白可在低温、低剂量诱导剂或短时间内产生高于正常的表达量,其可溶性不随之产生改变,但Cayir等[19]发现降低温度和浓度可改变蛋白的可溶性,可能是由于标签不同影响蛋白的可溶性。Western blotting结果显示,纯化后的重组融合蛋白enolase与牛环形泰勒虫阳性血清及GST标签抗体发生反应,说明该蛋白有较好的反应原性。
磷酸化是一种普遍存在的翻译后修饰(post-translational modified,PTM)类型,是由磷酸基团与氨基酸残基(丝氨酸(S)、苏氨酸(T)和酪氨酸(Y))结合所引起的反应[20]。这些特定的残基在分子水平上表现出不同的功能,相应产生的磷酸化反应也调节着一些生命活动,如细胞周期控制、信号转导、蛋白质间的相互作用等过程,且识别磷酸化位点有助于揭示磷酸化相关生物过程的分子机制[21]。本研究预测牛环形泰勒虫enolase蛋白有38个磷酸化位点,主要由蛋白激酶C/A(PKC/PKA)、肌酸激酶Ⅱ/Ⅰ(CKII/CKI)、cdc2构成,enolase可能通过磷酸化过程从而影响细胞的部分生命活动。如Leykauf等[22]在2010年发现恶性疟原虫的顶端膜抗原1(apical membrane antigen-1,AMA1)的第610位氨基酸受环单磷酸腺苷(cAMP)调节的蛋白激酶A(PKA)控制丝氨酸磷酸化,若丝氨酸突变为丙氨酸则会导致磷酸化修饰失败,从而影响虫体入侵过程。
不同构型、位置和数量使蛋白表现不同的功能[23]。α-螺旋参与构成蛋白质骨架,所以结构稳定、难以形成表位嵌合抗体,但无规则卷曲及β-转角则不同,位于蛋白表面,排列松散,易弯曲、折叠,所以能形成很好的抗原表位[24]。本研究预测发现,牛环形泰勒虫enolase蛋白二级结构中α-螺旋与无规则卷曲的占比较大,而且通过预测enolase抗原表位、构建可信的三级结构及抗原标记发现,抗原位点大多位于表面,可能有利于宿主免疫系统识别和捕捉。蛋白质的亚细胞定位可初步预测蛋白在细胞中所处的位置进而分析其功能[25],本研究预测enolase主要存在于细胞质(22%),其次是核糖体(5%),该结果与enolase蛋白糖酵解相关功能相一致。
在蛋白互作网络中,每个蛋白都具有不同的特征,包括氨基酸序列、亚细胞位置和蛋白质结构域。本研究通过STRING构建牛环形泰勒虫enolase蛋白的互作蛋白网络,预测网络显示,enolase蛋白与PGK、PGAM、NDK、HSP70等存在相互作用。Paludo等[26]分析蛋白互作网络表明,enolase是网络中的一个中心节点,除了与糖酵解和能量代谢相关的蛋白典型相互作用外,也是与不同生物过程(如转录、发育和凋亡等)相关的蛋白簇的一部分。Didiasova等[27]和Perconti等[28]在心肌细胞中证明,enolase-1与HSP70、α-enolase与HSPA8的相互作用可对其产生抗氧化应激的保护。本研究的蛋白预测网络分析可为enolase蛋白参与细胞供能、抗氧化应激提供数据参考。
本研究成功克隆出**牛环形泰勒虫enolase基因,构建原核表达载体pGEX-4T-1-enolase,Western blotting结果显示该蛋白有较好的反应原性。生物信息学预测分析enolase蛋白可能为稳定性亲水蛋白,有38个磷酸化位点、17个抗原表位,主要位于细胞质,与糖酵解相关基因PGAM及Hsp70家族存在互作。
猜你喜欢磷酸化泰勒抗原阿尔茨海默病脑TAU蛋白磷酸化位点综述中风与神经疾病杂志(2022年9期)2022-10-19苏州市D抗原阳性无偿献血者C和e抗原阴性率及其筛血策略*交通医学(2022年2期)2022-06-14T69E模拟磷酸化修饰对Bcl-2与Nur77相互作用的影响波谱学杂志(2022年1期)2022-03-15GDM孕妇网膜脂肪组织中Chemerin的表达与IRS-1及其酪氨酸磷酸化分析昆明医科大学学报(2022年1期)2022-02-28血清铁蛋白、IL-6和前列腺特异性抗原联合检测在前列腺癌诊断中的应用现代临床医学(2021年5期)2021-11-02泰勒展开式在函数中的应用数理报(学习实践)(2021年5期)2021-04-07负载抗原DC联合CIK对肝癌免疫微环境的影响昆明医科大学学报(2021年1期)2021-02-07关于血型问题的释疑生物学教学(2018年10期)2018-11-29磷酸化肽富集新方法研究进展分析化学(2017年12期)2017-12-25展示不完美发明与创新·中学生(2016年8期)2016-05-14